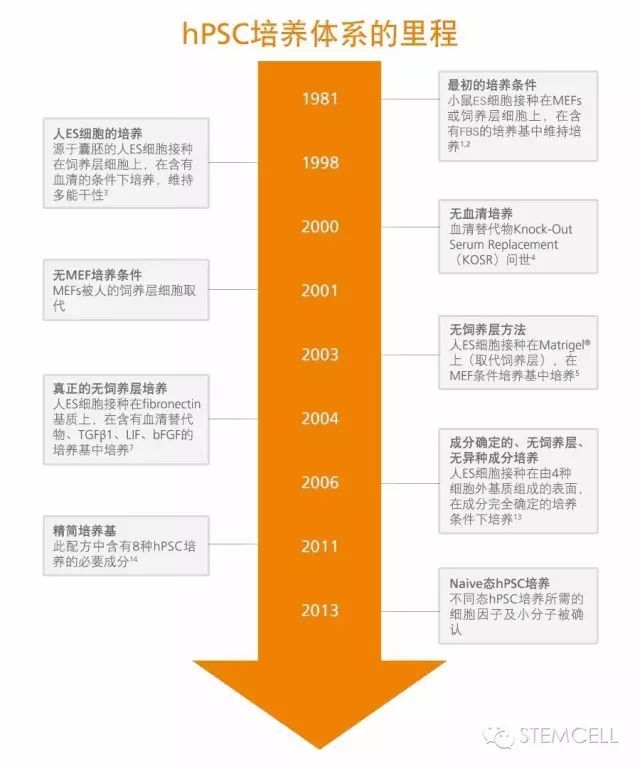
多能干细胞培养体系进化史:从MEFs到Naïve State
体外培养hPSCs方法的建立
自人胚胎干细胞(hESCs)体外培养方法问世以来,人多能干细胞(hPSCs)的培养条件不断的被改善提高(1,2)。最初,培养此类细胞需要借助于小鼠胚胎成纤维细胞(mouse embryonic fibroblasts, MEFs)或者饲养层细胞,加上含胎牛血清(FBS)的培养基3。但是,多能干细胞的临床应用前景使人们很快意识到培养条件中不可存在这些具有潜在免疫原性的动物源成分,因此许多hPSC培养的方法都致力于消除培养条件中不确定的和非人源的成分(4-6)。如下图所示,hPSC的培养逐渐演变成无需饲养层,培养基中则含有生长因子(bFGF 和/或 TGF-β)和血清替代物,及使用胞外基质Matrigel包被培养皿(7,8)。随后许多文献也相继发表了成分确定的,无饲养层,无异种成分(即不含动物成分)的hPSC培养的配方(9-12)。

培养条件:饲养层 vs 无饲养层
2006年,Dr. James Thomson实验室的Dr. Tenneille Ludwig以及WiCell Research Institute(Madison, WI)的学者们发表了在成分完全确定、无饲养层并无异种成分的条件下衍生新的ES细胞系(12, 13)。他们结合了bFGF(维持PSC的自我更新能力),TGF-β(抑制PSC的分化)和一系列其他的重要因子,保持PSC的多能性,使hPSC体外培养条件发生了质的飞越。该配方的改良版 - mTeSR1已经成为无饲养层培养的金标准,截止于2016年,mTeSR1被引用超过1100次。
2011年,Dr. James Thomson实验室的 Dr. Guokai Chen发表了一种低蛋白,更精简的hPSC培养基配方,并命名为E8(14)。TeSR-E8 (E8配方)含有hPSC培养8种必要的成分:insulin, selenium, transferrin, L-ascorbic acid, bFGF,TGFβ,NaHCO3,DMEM/F12(14)。
细胞贴壁基质:Matrigel vs Vitronectin
Matrigel是一种源于Engelbreth-Holm-Swarm(EHS)小鼠肉瘤细胞的基底膜基质,与mTeSR1 配合使用于hPSCs的培养(12)。但Dr. Tenneille Ludwig发现这也是一种产生免疫原性蛋白的潜在来源,因此许多研究都致力于找到比Matrigel更加成分确定的基质。其中比较有前景的是通过化学连接到培养皿上的人工多肽(15,16)和能与某种integrins和细胞粘附因子结合的重组蛋白(17,18)。由Primorigen Biosciences公司研制开发的Vitronectin XF,是一种成分确定,无异种成分的基质,可以替代Matrigel支持hPSC的维持培养。Vitronectin XF与TeSR家族的所有培养基兼容,与mTeSR1一起使用达到成分确定的培养系统,或与TeSR2或TeSR-E8培养基一起使用时,达到完全无异种成分的培养系统。
细胞传代:团块 vs 单细胞
传统的hPSC传代方法是以直径为50 – 200μm的团块进行传代,这种传代方法的优势在于可以在多次传代(>20代)后仍保持细胞的核型。hPSC也可进行单细胞传代,但有文献报道,此种方法会对细胞造成不需要的选择压力从而导致核型改变,因此不被推荐(19, 20)。使用单细胞传代时,应定期进行检测以保证核型稳定。
细胞传代:酶 vs 无酶
在无饲养层条件下培养的hPSC可通过刮擦和/或传代酶(如分散酶)将集落解离成团块后进行传代。但是此过程十分耗时,且团块的大小很难控制。虽然酶传代的果效不错,但酶会消化细胞外蛋白,导致细胞壁损伤,且需要在种细胞之前使其失活。
无酶传代工具如温和细胞解离液(Gentle Cell Dissociation Reagent, GCDR)由此应运而生。GCDR不会破坏细胞表面蛋白,无需进行失活处理,对细胞十分温和,可以使传代比例大大提高。
2015年,一种新型无酶传代工具ReLeSR问世了。无需手工刮擦,ReLeSR可将未分化的hPSC以团块的形式从培养皿上分离,而分化的细胞仍保留在培养皿上。这种传代方式大大节省了时间,并且可以用于密封容器的细胞传代。
大规模hPSC培养:2D vs 3D
hPSC在药物筛选,毒性检测和细胞治疗领域中的应用需要大量的起始细胞,某些临床应用所需的细胞数已经大大的超过了2D培养能够提供的细胞数量,因此3D悬浮培养应运而生。在3D悬浮培养中,hPSCs可以附着在微载体上或者以团块的形式进行培养;培养的容器可以是摇瓶或大型搅拌生物反应器(21-25)。hPSC悬浮培养的要求与贴壁培养的要求不同。 例如,在悬浮培养中,hPSC可以不用基质,以聚集体的方法进行培养,这是在2D培养中无法达到的。另外,在大规模生物反应器中进料策略(即灌注对分批进料)更为重要。 因此,许多研究仍对用于大规模hPSC生产的方案进行优化,以提高产量、稳定性和效率。在2016年ISSCR会议上,第一款用于hPSCs悬浮培养的培养基映入人们的眼帘 - mTeSR3D。通过优化配方和分批进料的培养方法,mTeSR3D提供一个高性价比的方法,可在短短2-3周之内,培养出1x109细胞!
不同态hPSC培养:Naïve-like vs Primed
传统意义上的hPSCs被认为处在“primed state” ,与小鼠植入后外胚层干细胞(EpiSCs)相似(26)。相比之下,小鼠的ES细胞被认为处在naïve或ground state,更具有干性。最近, 多个实验室比较了小鼠ES细胞和传统hPSCs,发现他们显示出不同的基因表达模式,并且对体外培养的要求也不同(27-29)。具体来说,维持未分化状态的小鼠ES细胞需要包含白血病抑制因子(LIF)的培养条件,而hPSC或小鼠EpiSC则在FGF和Activin中培养,并对LIF不响应27。有研究表明primed state的hPSCs可以被转回到ground state(28, 30-32),而第一款支持hPSCs在naïve-like state的培养基也已经问世 - RSeT。使用mTeSR1和RSeT培养基,可以使hPSCs在primed state和naïve-like state之间随意切换。
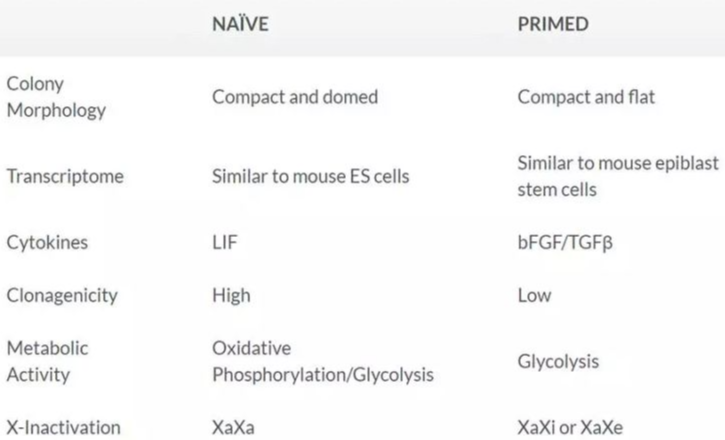
Table 1. naïve-like state和primed state多能干细胞的比较。
结束语
hPSCs的培养系统在过去的几十年里面有了大幅度的进步,这使得hPSCs培养更加简单,更具有一致性,更易于扩大化,这一切都使hPSCs在治疗,药筛,毒检中的应用更进一步。如果您对文章中提到的培养系统有兴趣或问题,欢迎您关注我们的公众账号,或与我们通过电话/邮件联系。
References
1.Evans MJ & Kaufman MH. (1981) Establishment in culture of pluripotential cells from mouse embryos. Nature 292(5819): 154–6.
2.Martin GR. (1981) Isolation of a pluripotent cell line from early mouse embryos cultured in medium conditioned by teratocarcinoma stem cells. Proc Natl Acad Sci U S A 78(12): 7634–8.
3.Thomson JA et al. (1998) Embryonic stem cell lines derived from human blastocysts. Science 282(5391): 1145–7.
4.Amit M et al. (2000) Clonally derived human embryonic stem cell lines maintain pluripotency and proliferative potential for prolonged periods of culture. Dev Biol 227(2): 271–8.
5.Hovatta O et al. (2003) A culture system using human foreskin fibroblasts as feeder cells allows production of human embryonic stem cells. Hum Reprod 18(7): 1404–9.
6.Xu C et al. (2001) Feeder-free growth of undifferentiated human embryonic stem cells. Nat Biotechnol 19(10): 971–4.
7.Amit M et al. (2004) Feeder layer- and serum-free culture of human embryonic stem cells. Biol Reprod 70(3): 837–845.
8.Levenstein ME et al. (2006) Basic fibroblast growth factor support of human embryonic stem cell self-renewal. Stem Cells 24(3): 568–74.
9.Vallier L et al. (2005) Activindal and FGF pathways cooperate to maintain pluripotency of human embryonic stem cells. J Cell Sci 118(19): 4495–509.
10.Lu J et al. (2006) Defined culture conditions of human embryonic stem cells. Proc Natl Acad Sci U S A 103(15): 5688–93.
11.Yao S et al. (2006) Long-term self-renewal and directed differentiation of human embryonic stem cells in chemically defined conditions. Proc Natl Acad Sci U S A 103(18): 6907–12.
12.Ludwig TE et al. (2006) Feeder-independent culture of human embryonic stem cells. Nat Methods 3(8): 637–46.
13.Ludwig TE et al. (2006) Derivation of human embryonic stem cells in defined conditions. Nat Biotechnol 24(2): 185–7.
14.Chen G et al. (2011) Chemically defined conditions for human iPSC derivation and culture. Nat Methods 8(5): 424–9.
15.Melkoumian Z et al. (2010) Synthetic peptide-acrylate surfaces for long-term self-renewal and cardiomyocyte differentiation of human embryonic stem cells. Nat Biotechnol 28(6): 606–10.
16.Villa-Diaz LG et al. (2010) Synthetic polymer coatings for long-term growth of human embryonic stem cells. Nat Biotechnol 28(6): 581–3.
17.Rodin S et al. (2010) Long-term self-renewal of human pluripotent stem cells on human recombinant laminin-511. Nat Biotechnol 28(6): 611–5.
18.Nagaoka M et al. (2006) E-cadherin-coated plates maintain pluripotent ES cells without colony formation. PLoS One 1: e15.
19.Draper JS et al. (2004) Recurrent gain of chromosomes 17q and 12 in cultured human embryonic stem cells. Nat Biotechnol 22(1): 53–4.
20.Buzzard JJ et al. (2004) Karyotype of human ES cells during extended culture. Nat Biotechnol 22(4): 381–2; author reply 382.
21.Olmer R et al. (2010) Long term expansion of undifferentiated human iPS and ES cells in suspension culture using a defined medium. Stem Cell Res 5(1): 51–64.
22.Oh SKW et al. (2009) Long-term microcarrier suspension cultures of human embryonic stem cells. Stem Cell Res 2(3): 219–230.
23.Singh H et al. (2010) Up-scaling single cell-inoculated suspension culture of human embryonic stem cells. Stem Cell Res 4(3): 165–79.
24.Krawetz R et al. (2010) Large-Scale Expansion of Pluripotent Human Embryonic Stem Cells in Stirred-Suspension Bioreactors.
25.Zweigerdt R et al. (2011) Scalable expansion of human pluripotent stem cells in suspension culture. Nat Protoc 6(5): 689–700.
26.Rossant J. (2008) Stem Cells and Early Lineage Development. Cell 132(4): 527–531.
27.Nichols J et al. (1998) Formation of pluripotent stem cells in the mammalian embryo depends on the POU transcription factor Oct4. Cell 95(3): 379–391.
28.Takashima Y et al. (2014) Resetting Transcription Factor Control Circuitry toward Ground-State Pluripotency in Human. Cell 158(6): 1254–1269.
29.Marks H et al. (2012) The transcriptional and epigenomic foundations of ground state pluripotency. Cell 149(3): 590–604.
30.Gafni O et al. (2013) Derivation of novel human ground state naive pluripotent stem cells. Nature 504(7479): 282–6.
31.Theunissen TW et al. (2014) Systematic Identification of Defined Conditions for Induction and Maintenance of Naive Human Pluripotency. Cell Stem Cell 15(4): 471–487.
32.Chan YS et al. (2013) Induction of a human pluripotent state with distinct regulatory circuitry that resembles preimplantation epiblast. Cell Stem Cell 13(6): 663–675.