联系我们
一、细胞表面流式染色操作步骤
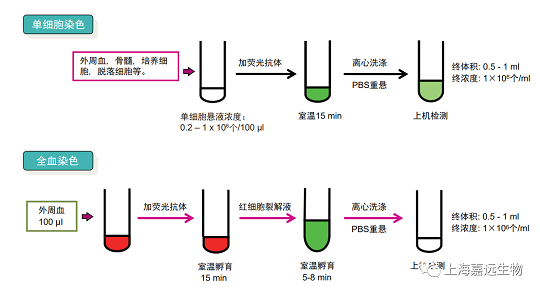
二、详细操作步骤
1、准备细胞:取培养的细胞离心(300 g/5min)弃去上清,加入一定量PBS洗涤一次,弃去上清,弹散细胞,细胞重悬到5*106 ~10*10⁶ /ml之间;
2、取100 μl的细胞于EP管或流式管内,分三管染色,第一管Anti-human CD90 FITC, Anti-human CD105 APC,Anti-human CD45 PE-Cy7各加5μl;第二管 Anti-human HLA-DR FITC, Anti-human CD34 PE-Cy7, Anti-human CD73- APC各加5 μl,第三管Mouse IgG1 K Isotype Control FITC 0.6 μl, Mouse IgG1 Isotype Control PE-Cy71.2 μl, Mouse IgG1 Isotype Control APC 1.2 μl;
3、加入相应的抗体后混匀,建议弹管子,尽量不用枪头直接吹打,室温避光孵育15min,染色过程中再混匀一次;
4、染色完成后加入1 ml的PBS洗涤细胞,离心300 g/5min;
5、弃去上清,弹散细胞,加入500 μl PBS重悬,上机检测。
Tips:
1、同型对照是根据染色抗体的用量来计算的,所以每种同型对照可能加入量可能不一样。
2、先上机检测同型对照管,各检测通道以这一管的信号设为阴性,再上机检测抗体染色管。
3、最后结果的显示用峰图来表示,每种抗体的检测结果都与对应的同型对照染色结果叠加展示(overlay )。
三、鉴定结果
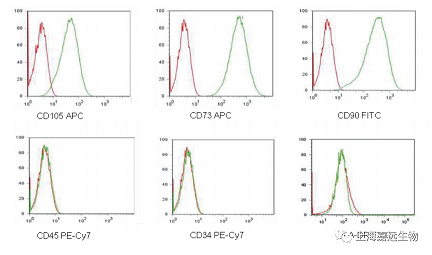
Tips:CD90表达量非常高,所以建议用FITC荧光染料,FITC/PE-Cy7/APC这三种荧光染料之间几乎没有补偿, 所以这三种染料一起染色不需调节补偿,如果是做脐带干细胞的鉴定,CD105抗体最好选择SN6克隆号, 其他克隆号染色结果不好(某些克隆号染不上)。
四、鉴定抗体
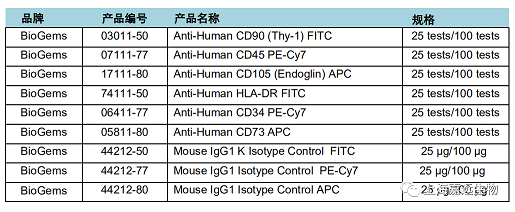
Tips:国际细胞治疗协会间充质和组织干细胞委员会2006年提出了MSC鉴定的最低标准,关于细胞表型的要求是表达CD90, CD105和CD73, 不表达CD45, CD34, CD14或CD11b, CD79a或CD19和HLA-DR; 阳性指标都需要染色,阴性指标一般选择2-3个指标,因为是做细胞表型鉴定,所以最好要配齐同型对照。
五、流式常见问题解答
1.问:流式染色离心力如何选择?
答:若只是表面染色,细胞离心力推荐300 g~500 g,若细胞比较大(肿瘤细胞)300 g离心,细胞比较小(淋巴细 胞)500 g离心,离心时间5~10 min。若是胞内染色,因涉及固定破膜过程,细胞会脱水变轻,因此需提高离 心力,推荐离心力600~800 g,根据不同品牌的破膜剂及破膜时间来选择具体离心力,离心时间建议10~15 min。
2.问:流式染色时间及温度如何选择?
答:流式染色是抗原抗体的结合反应,此过程结合非常快,而且非常牢固,但染色过程要尽量让所有抗原都能 结合抗体分子,所以加入抗体一定要混匀,我们一般选择室温染色15 min或者4℃染色30 min,染色中途混 匀一次,建议轻弹管子(枪头吹打可能会对细胞受损,死细胞增多,导致非特异性结合增加)。
3.问:流式染色需要购买 FcγR Blocking 吗?
答:若染了同型对照, FcγR Blocking这一步骤可以省略,若没有染同型对照,只要是知道抗原清楚表达,细胞分 群很明显的也不用FcγR Blocking,总之言之,绝大多情况下都不需要这一步骤。当然磁珠分选都要有这 一过程,因为磁珠分群没有办法去除背景,Fc受体的结合对结果会影响很大(特别是分选免疫细胞)。
4.问:流式上样速度如何选择?
答:一般建议上样速度控制在10000个/秒以内,上样速度太高,容易堵塞吸样针,并且会导致检测不准确。
5.问:细胞体外放置多久仍可染色?
答:若细胞来不及处理,只有表面染色,细胞可放在4℃ 6~12 h,对染色结果影响不大;若是胞内因子的染色需 要及时处理,因细胞有刺激过程,需要细胞保证活性。对于凋亡染色、线粒体膜电位分析及检测胞内酶活 性必须要及时染色。
6.问:流式染色需要购买Staining Buffer吗?
答:没必要,Staining Buffer的配方就是PBS加入1%BSA或FBS。可实验室自行配置。配置后最好过滤去除 一些未溶解的颗粒,因颗粒杂质容易堵塞流式吸样管。
7.问:细胞固定后能染色吗?
答:建议固定后不要染色,因甲醛固定后会导致某些抗原表位的丢失(甲醛固定时细胞氨基基团会发生交联, 从而掩盖抗原的表位),另外,残留的甲醛会和抗体分子非特异性结合,这些都会导致染色效率不高;若因 不可抗拒原因需要固定后染色,一定要清楚固定后抗原是否受影响(可实验验证),建议PBS洗涤细胞两次 后染色。
8.问:全血如何染色?
答:如果是检测全血里面的白细胞,不要分离PBMC或者PMN染色,可以直接用全血染色,染色完成后加入红 细胞裂解液裂解红细胞,重悬后直接上机即可。不建议裂红后再染色,因这样不仅增加了操作步骤,造成 细胞损失,而且红细胞裂解液会对白细胞膜有一定的影响,可能会造成细胞膜表面抗原的丢失,影响染色 结果。
9.问:如何减少补偿的干扰?
答:因为不同激光器激发的荧光染料之间几乎没有补偿的干扰,所以对于多激光器的仪器我们可通过选择不 同激光器激发的染料来避免补偿的干扰,选择同一激光器激发的染料是,尽量选择染料之间发射光谱不重 叠的染料。
10.问:如何正确选择及使用同型对照?
答:购买抗体时一定要知道该抗体的种属来源以及亚型,同型对照应该选择与该抗体种属来源一样、亚型一 样以及颜色标记一样的,因为抗体有不同的克隆号,在购买时选择性比较多,所以我们应当尽量购买已有 同型对照对应的抗体,同型对照的使用量应该与对应抗体的使用量一致,注意这里的量不是指的体积,而 是指的抗体含量(重量),因此需要我们根据同型对照的浓度来换算最终加入的同型对照的体积。
11.问:细胞染色后是否可以固定?
答:有时因实验安排,需要隔天检测,这时候需要固定细胞,一般我们用4%多聚甲醛(有成品的液体,也可买粉末自行配 置)或者用荧光抗体保存液固定细胞,但如果染色的抗体颜色是耦联染料(PE-Cy5、PE-Cy7、PerCp-Cy5.5)不能 固定,因为耦联染料在固定时会解偶联,这会导致荧光染料降解。荧光抗体保存液的配方是(2 g葡萄糖,1 ml甲醛加 到100 ml PBS里溶解后再加0.5 ml 20%叠氮钠)。
12.问:细胞染色的阴性对照管如何设定?
答:若有同型对照,应以同型对照为阴性对照管,画门时,阴性对照管的比例应界定在0%~3%之间,这是默认的不表 达。在没有设置同型对照时(可参照前文中同型对照章节的介绍),可用裸细胞来设置阴性对照管。
13.问:细胞自发荧光如何解决?
答:培养时间较久的原代细胞、药物处理(药物本身就有自发荧光)的细胞、植物细胞(含有叶绿素)、分泌核黄素的 细胞、这些细胞自发荧光比较强,在流式染色中不能忽视,一般自发荧光在第一检测通道(FITC)和第二检测通道 (PE)上干扰比较多,当然其他检测通道也有(特别是药物干扰),存在自发荧光的情况下,一定要注意对染色结果 的影响(特别是做低表达抗原检测时),如果允许,尽量选择避开干扰的荧光染料。在做凋亡检测时,经常会遇到自 发荧光干扰的问题,一定要注意选择避开干扰的Annexin V染料,如Annexin V-APC。
14.问:死活细胞染料在流式染色中如何应用?
答:流式染色过程中,死细胞的非特异性结合较多,因此对于样本中产生的死细胞较多的(例如样本提前刺激会产生死 细胞),建议在做流式染色前,多一步进行死活细胞染色,这样会减少后续分析时死细胞造成的干扰。